Significado de Eletronegatividade
O que é a Eletronegatividade:
A eletronegatividade indica a tendência de um átomo em atrair um par de elétrons em uma ligação covalente, que ocorre quando esse átomo compartilha um ou mais pares de elétrons.
Se dois átomos ligados possuem os mesmos valores de eletronegatividade, eles compartilham elétrons igualmente em uma ligação covalente. No entanto, geralmente os elétrons em uma ligação química são mais atraídos por um átomo (o mais eletronegativo) do que pelo outro.
Se os valores de eletronegatividade forem muito diferentes, os elétrons não serão compartilhados. Um átomo, neste caso, monopoliza os elétrons de ligação do outro átomo, formando uma ligação iônica.
Exemplos de eletronegatividade
Um exemplo de eletronegatividade é o átomo do Cloro, que tem uma eletronegatividade maior do que o átomo de Hidrogênio. Portanto, os elétrons de ligação estarão mais próximos do Cl (cloro) que do H (hidrogênio) na molécula de HCl (ácido clorídrico ou cloreto de hidrogênio).
Outro exemplo é o que ocorre na molécula de O2 (oxigênio), onde ambos os átomos possuem a mesma eletronegatividade. Ou seja, os elétrons na ligação covalente são compartilhados igualmente entre os dois átomos de oxigênio.
Eletronegatividade na tabela periódica
Pode-se dizer que a eletronegatividade é uma propriedade periódica que aumenta da esquerda para a direita e de baixo para cima na Tabela Periódica.
A eletronegatividade e a energia de ionização seguem a mesma tendência da tabela periódica, por isso elementos que possuem baixa energia de ionização tendem a também ter baixa eletronegatividade.
Os núcleos desses átomos não exercem uma forte atração nos elétrons. Da mesma forma, elementos que possuem altas energias de ionização tendem a ter altos valores de eletronegatividade, e o núcleo atômico exerce forte influência sobre os elétrons.
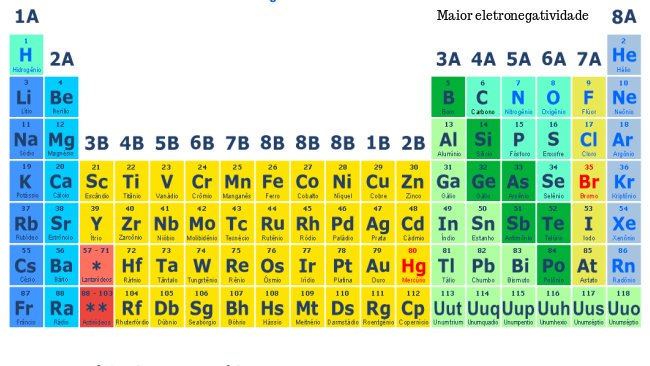
Exemplo de eletronegatividade na tabela periódica, encontrada em sua maior quantidade nos elementos da esquerda para a direita.
O elemento mais eletronegativo é o Flúor (F) e os elementos menos eletronegativos (ou mais eletropositivos) são o Frâncio (Fr) e o Césio (Cs).
Já os gases nobres, por não fazerem ligações químicas, têm a sua eletronegatividade nula ou pouco significativa.
Escala da eletronegatividade
A Escala de Pauling é a mais utilizada para se calcular a eletronegatividade. Ela foi criada por Linus Pauling, que atribuiu a eletronegatividade de Flúor como 4 e do Frâncio como 0,7 e, em seguida, calculou a eletronegatividade de outros elementos entre esses números, usando energias de ligação.
Porém, ao realizar cálculos em uma ampla gama de compostos, é atribuída uma eletronegatividade de 3,98 ao Flúor. Isso acontece pois este valor dá uma melhor consistência interna.
Outra escala é a Escala de Mulliken, que baseia os valores de eletronegatividade na seguinte equação: Eletronegatividade = 0,5 x (Potencial de Ionização + Afinidade Eletrônica)
A eletronegatividade é uma escala relativa, ou seja, é calculada e não medida.
Diferença entre eletronegatividade e eletropositividade
Na eletronegatividade, um átomo pode atrair um par compartilhado de elétrons em seu estado combinado. Já na eletropositividade, o átomo pode retirar um par compartilhado de elétrons em seu estado combinado.
Nota-se, então, que ambos são termos contraditórios, ou seja, um átomo mais eletronegativo é, consequentemente, menos eletropositivo e vice-versa. Além disso esses valores dependem do átomo ao qual se liga durante a ligação covalente.
Veja também o significado de:




