Ácidos e Bases
Qual a diferença entre ácidos e bases?
Os ácidos e as bases são dois tipos de substâncias corrosivas, porém eles são considerados opostos químicos.
Uma das maiores diferenças entre os ácidos e bases é que as bases, em contato com solução aquosa, liberam íons negativos, as hidroxilas (OH-). Já os ácidos, em contato com água liberam íons positivos de hidrogênio (H+).
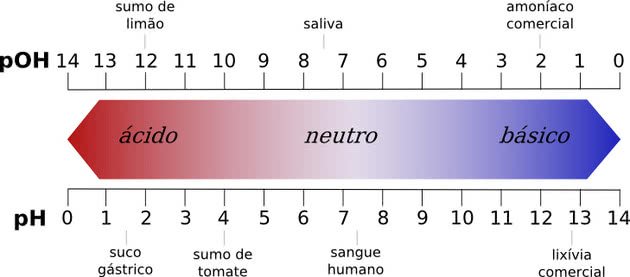
Qualquer substância com um valor de pH entre 0 até 7 é considerada ácida, enquanto um valor de pH de 7 a 14 é uma base. O valor 7 é o neutro, que corresponde à água.
| Ácidos | Bases | |
|---|---|---|
| Definição de Arrhenius |
Um ácido é qualquer composto químico que, em solução aquosa, libera íons de hidrogênio (H+). |
Uma base, ou álcali, é uma substância que, em solução aquosa, libera hidroxilas, íons negativos (OH-) |
| Definição de Brönsted-Lowry | Um ácido é uma substância que doa um próton. | Uma base é qualquer substância que recebe um próton. |
| Definição de Lewis | Durante uma ligação química, os ácidos são os que recebem pares eletrônicos. | Em uma ligação química, as bases são os que cedem pares eletrônicos. |
| Valor do pH | Menor que 7.0. | Maior que 7.0. |
| Características físicas | Os ácidos podem ocorrer de forma sólida, líquida ou gasosa, dependendo da temperatura. | Frequentemente sólidas, exceto amônia, que é um gás. |
| Estrutura | Ácidos são moleculares, ou seja, formados por ligações covalentes em que há compartilhamento de elétrons. | As bases podem ser iônicas ou moleculares. |
| Fórmula química | Os ácidos possuem fórmula química com H no início, por exemplo, o HCl (ácido clorídrico). O Ácido acético (vinagre) é uma exceção, sendo o CH3COOH. | As bases possuem OH no final de sua fórmula, por exemplo, NaOH (hidróxido de sódio). |
| Solubilidade em água | Costumam ser bastante solúveis em água. | A maioria das bases é praticamente insolúvel. |
| Reação no indicador Fenolftaleína | Permanece incolor. | Deixa a solução rosa. |
| Teste de Ph (com papel de tornassol ) | Fica vermelho. | Fica azul. |
| Condutividade elétrica | Apenas conduzem corrente elétrica quando estão dissolvidos em água. | Também conduzem corrente elétrica em solução aquosa. |
| Exemplos | Ácido acético, ácido sulfúrico. | Hidróxido de sódio, amoníaco |
O que são ácidos e bases
Os ácidos são compostos iônicos que quando dissolvido em água geram um íon positivo de hidrogênio (H +). As bases, por outro lado, são compostos iônicos que formam um íon hidróxido de carga negativa (OH-) em água.
Essa definição, criada pelo cientista sueco Svante Arrhenius, é a mais utilizada para classificar os ácidos e bases, porém, existem outras definições.
A definição dada por Johannes N. Bronsted e Thomas Lowry, conhecida como definição protônica, diz que os ácidos são substâncias que doam um próton, enquanto as bases são as que recebem um próton.
Já na definição dada pelo norte-americano Gilbert Newton Lewis, os ácidos são as substâncias que recebem pares eletrônicos em uma ligação química, enquanto as bases cedem os pares.
PH dos ácidos e bases
Todos os compostos químicos têm um valor de pH, que pode variar de 0 a 14, onde os números representam a concentração de íons de hidrogênio em uma solução.
O pH neutro é o pH da água pura, que é 7. Qualquer substância com um valor de pH entre 0 até 7 é considerada ácida, enquanto um valor de pH de 7 a 14 é uma base.
Quanto mais inferior à 7,0 o ácido for, mais forte ele é. Nas bases, quanto mais alto o valor do pH, mais forte ela será.
Características dos Ácidos:
- Possui gosto amargo;
- Pode queimar a pele quando tocado;
- Pode corroer metais e pele;
- Deixa o papel tornassol vermelho;
- No indicador universal ele é identificado pelas cores vermelhas ou laranjas.
Características das Bases
- Gosto adstringente;
- Ao tocar, se sente algo viscoso;
- Muitas bases reagem com ácidos e geram sais;
- Bases fortes podem reagir violentamente com ácidos;
- Bases tornam o papel de tornassol azul;
Indicadores de ácidos e bases
Os indicadores de pH, ou indicadores ácido-base, são substâncias utilizadas para se descobrir se a solução se trata de um ácido ou uma base.
Isso é possível por causa de suas propriedades físico-químicas, que possuem a capacidade de mudar de cor de acordo com o pH da substância testada.
Entre os muitos indicadores artificiais utilizados em laboratório, os mais conhecidos são a fenolftaleína, o papel de tornassol e os indicadores universais.
- A fenolftaleína permanece incolor em contato com ácido, e fica rosa em contato com bases.
- O papel de tornassol fica azul com bases e vermelha na presença de ácidos.
- O indicador universal é o mais preciso dos indicadores ácido-base, pois ele apresenta diferentes cores de acordo com cada valor de pH.

Aplicações para ácidos e bases no dia-a-dia
Os ácidos são frequentemente utilizados para remover ferrugem de metais, como eletrólito em baterias, para processamento de minerais, para produzir fertilizantes e gasolina e como aditivos em alimentos e bebidas.
As bases são usadas principalmente na limpeza, como detergentes para lavar louça e sabão para roupa, limpadores de forno e removedores de manchas.


