Diagrama de Linus Pauling
O que é o Diagrama de Linus Pauling:
Diagrama de Linus Pauling ou Diagrama de Distribuição Eletrônica consiste num modelo que auxilia na configuração dos elétrons dos átomos e dos íons através de subníveis de energia. Este método é usado na Química para determinar algumas características dos átomos.
Também conhecido como Princípio de Aufbau, o Diagrama de Linus Pauling ajuda a traçar algumas propriedades dos átomos, como o número de camadas preenchidas por elétrons e o número de camadas de elétrons que o átomo possui, por exemplo.
O cientista americano vencedor de dois prêmios Nobel, Linus C. Pauling (1901 - 1994) é o responsável por desenvolver esta teoria, considerada uma das que melhor explica a distribuição eletrônica ao redor dos átomos.
Como se sabe, a tabela periódica organiza os elementos químicos a partir do número atômico em ordem crescente. O Diagrama de Linus Pauling, em conjunto com a tabela periódica, ajuda a fornecer informações sobre os átomos que formam esses elementos.
Como dito, o diagrama de Linus Pauling se baseia nos subníveis de energia do átomo para organizar os elétrons. Estes são dispostos a partir do de menor para o de maior energia, quando o átomo se encontra no seu estado fundamental.
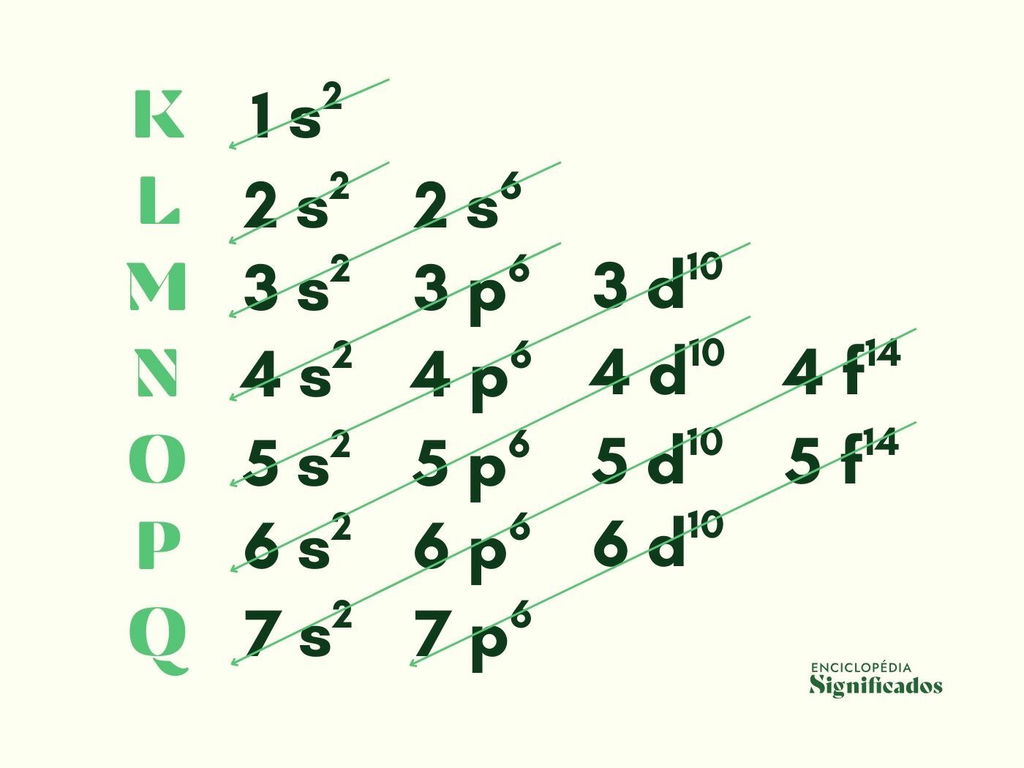
A eletrosfera dos átomos é formada por 7 (sete) camadas eletrônicas, representadas pelas letras: K, L, M, N, O, P e Q. Cada camada permite um número máximo de elétrons:
- K = até 2 elétrons.
- L = até 8 elétrons.
- M = até 18 elétrons.
- N = até 32 elétrons.
- O = até 32 elétrons.
- P = até 18 elétrons.
- Q = até 8 elétrons.
| Camadas Eletrônicas | N.º Máximo de Elétrons | Subníveis de Energia |
|---|---|---|
| K | 2 e- | 1s2 |
| L | 8 e- |
2s2 2p6 |
| M | 18 e- |
3s2 3p6 3d10 |
| N | 32 e- |
4s2 4p6 4d10 4f14 |
| O | 32 e- |
5s2 5p6 5d10 5f14 |
| P | 18 e- |
6s2 6p6 6d10 |
| Q | 8 e- |
7s2 7p6 |
Nota-se que a camada K apresenta apenas um subnível (s), que permite a existência de até 2 elétrons. A camada L tem dois subnível (s e p), sendo que p comporta até 6 elétrons. Ainda existem os subníveis d (com até 10 elétrons) e f (com 14 elétrons, no máximo).
| Subnível | Nº de Elétrons por Subnível |
|---|---|
| s = sharp (nítido) | até 2 elétrons |
| p = Principal | até 6 elétrons |
| d = diffuse (difuso) | até 10 elétrons |
| f = fundamental | até 14 elétrons |
Assim, a partir deste esquema, Pauling organizou os elétrons seguindo uma ordem crescente de energia nos diferentes subníveis.
Usando setas diagonais, encontra-se a seguinte sequência no Diagrama de Linus Pauling: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6.
Para praticar: Exercício sobre distribuição eletrônica (com gabarito resolvido)
-
Exercício sobre distribuição eletrônica (com gabarito resolvido)

-
Exercício sobre átomos (com questões explicadas)

- Cátions e Ânions
-
Tabuada completa de multiplicação, adição, divisão e subtração

-
Exercício sobre modelos atômicos para praticar (com respostas explicadas)

-
Exercício sobre química orgânica (com questões resolvidas e explicadas)

-
Exercício sobre propriedades da matéria para praticar (com respostas explicadas)

- O que é o Fogo
-
Heterogêneo

-
Stand By

