Átomos
O átomo é a unidade básica da matéria, isto é, a menor parcela em que um elemento pode ser dividido sem perder suas propriedades químicas.
Os átomos são formados por um núcleo composto por partículas de prótons e nêutrons e por elétrons que orbitam o núcleo, formando a eletrosfera.
A palavra átomo é de origem grega e significa "indivisível". Até o século XIX acreditava-se que o átomo era a menor parte da matéria, isto é, que seria impossível dividi-lo.
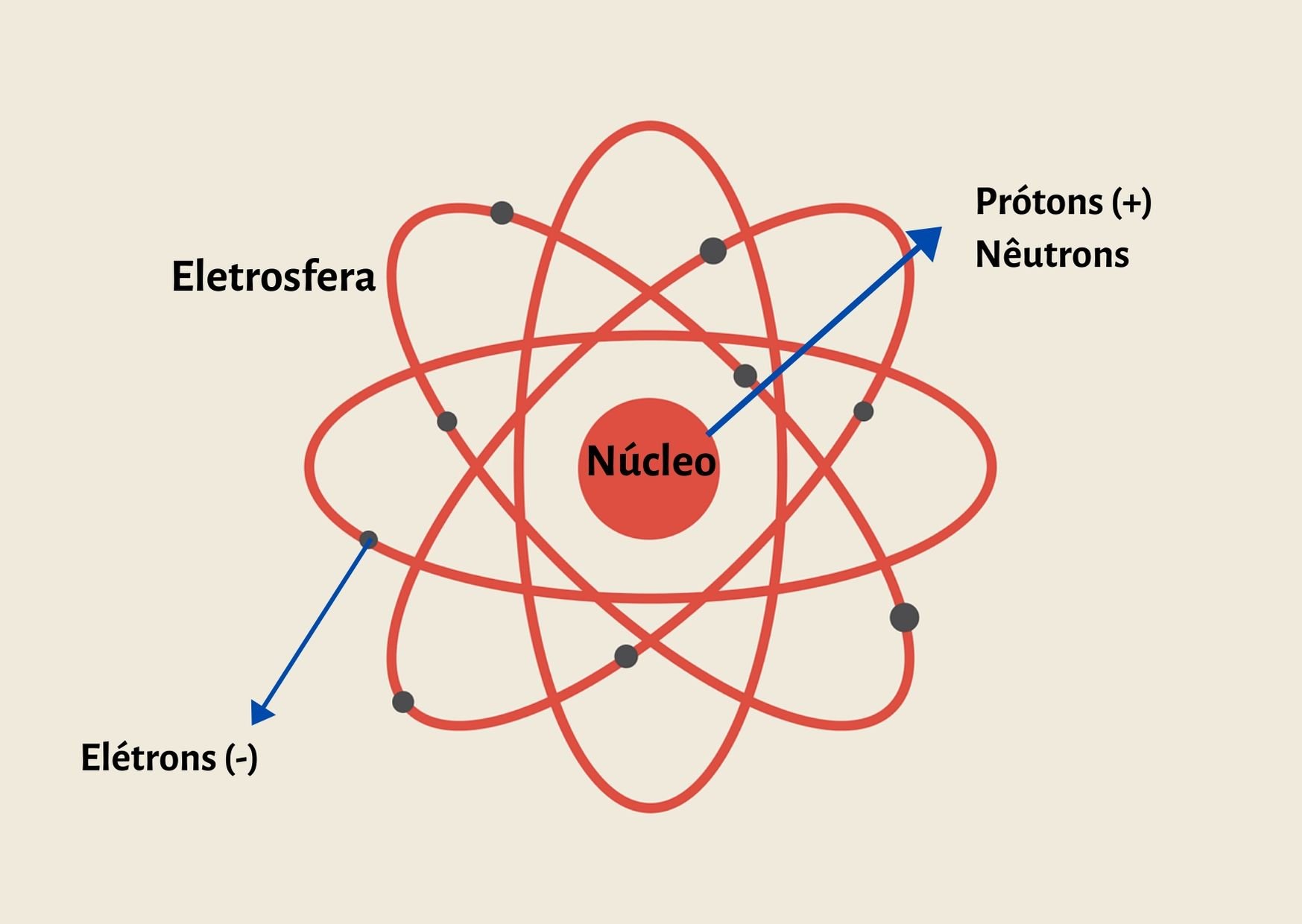
Um átomo é formado por prótons e nêutrons no núcleo e por elétrons na eletrosfera.
Estrutura e composição de um átomo
Os átomos são parcelas muito pequenas da matéria, tão pequenas que não podem ser enxergadas com microscópios comuns.
Sua estrutura é formada por um núcleo infinitamente pequeno e denso, composto por prótons e nêutrons e por uma eletrosfera composta por elétrons.
- Prótons (p): partículas positivas e com massa unitária.
- Nêutrons (n): partículas neutras (sem carga) e com massa unitária.
- Elétrons (e): partículas negativas e praticamente sem massa, em constante movimento orbital em volta no núcleo.
O núcleo representa 99,9% da massa de um átomo. A massa dos elétrons é praticamente irrelevante: um elétron tem massa 1836 vezes menor do que a massa dos prótons e nêutrons.
O movimento dos elétrons em volta do núcleo forma um campo eletromagnético. Os elétrons orbitam em volta do núcleo em uma velocidade tão alta que, se fosse possível enxergar o átomo, a eletrosfera seria vista como uma nuvem em torno do núcleo.
Os átomos são eletricamente neutros - eles possuem o mesmo valor absoluto de prótons (+) e elétrons (-), de maneira que sua carga se torna nula.
Caso um átomo receba ou perca elétrons, ele deixa de ser um átomo e passa a ser um íon, que pode ter carga positiva ou negativa:
- Se ele receber elétrons, fica carregado negativamente e se torna um ânion.
- Se ele perder elétrons, fica carregado positivamente e se torna um cátion.
Entenda mais sobre os cátions e ânions.
Estrutura da eletrosfera
A eletrosfera é formada pelos elétrons em movimento orbital, mas esses elétrons não estão dispostos aleatoriamente, existem camadas eletrônicas por onde essas partículas se distribuem.
Um átomo pode ter até sete camadas eletrônicas. Cada uma dessas camadas tem níveis energéticos diferentes, sendo que a camada mais externa é a camada mais energética.
Essas camadas são representadas pelas seguintes letras: K, L, M, N, O, P, Q. Sendo K a camada mais próxima do núcleo.
Nem todos os átomos têm as 7 camadas, o mercúrio, por exemplo, tem apenas 6. Mas independente do número de camadas, é regra que a última não pode ter mais do que 8 elétrons.
As camadas eletrônicas ainda são divididas em subníveis de energia, representados pelas letras: s, p, d, f.
História do átomo e modelos atômicos
A ideia de que a matéria poderia ser dividida em pequenas partes até que se chegasse em uma unidade tão pequena que não pudesse mais ser dividida existia desde os tempos da Grécia Antiga.
Demócrito, por volta de 400 a.C., foi o primeiro cientista a postular a existência dessa pequena partícula e deu-lhe o nome de “átomo”, que em grego significa “indivisível”.
Foi em 1803, que a primeira teoria consistente sobre os átomos foi elaborada. John Dalton defendeu que o átomo era a menor parte da matéria e que ele era indivisível.
Ao longo dos séculos seguintes, com o desenvolvimento da ciência e da tecnologia, novas descobertas sobre essa partícula foram feitas e postuladas em diferentes modelos atômicos.
1803 - Modelo de Dalton
Desenvolvido pelo professor John Dalton em 1803, esse modelo ficou conhecido como modelo da “bola de bilhar”, pois segundo ele os átomos eram esferas maciças, indivisíveis e indestrutíveis.

1898 - Modelo de Thomson
Joseph Thomson descobriu a existência dos elétrons e, segundo seu modelo, essas cargas estariam distribuídas de maneira uniforme pelo átomo, com cargas positivas.
O átomo no modelo de Thomson era esférico e não maciço e ficou conhecido como “pudim de passas”, onde as passas de um pudim representavam as cargas positivas e negativas.

1911 - Modelo de Rutherford
Rutherford fez uma descoberta importante sobre o átomo: a existência de um núcleo. Seu modelo dizia que o átomo era formado por um núcleo e por uma eletrosfera.
No núcleo estariam os prótons e os nêutrons e na eletrosfera os elétrons. Esse modelo ficou conhecido como "sistema solar".
O que Rutherford não soube explicar era como os elétrons não colapsavam com o núcleo do átomo.

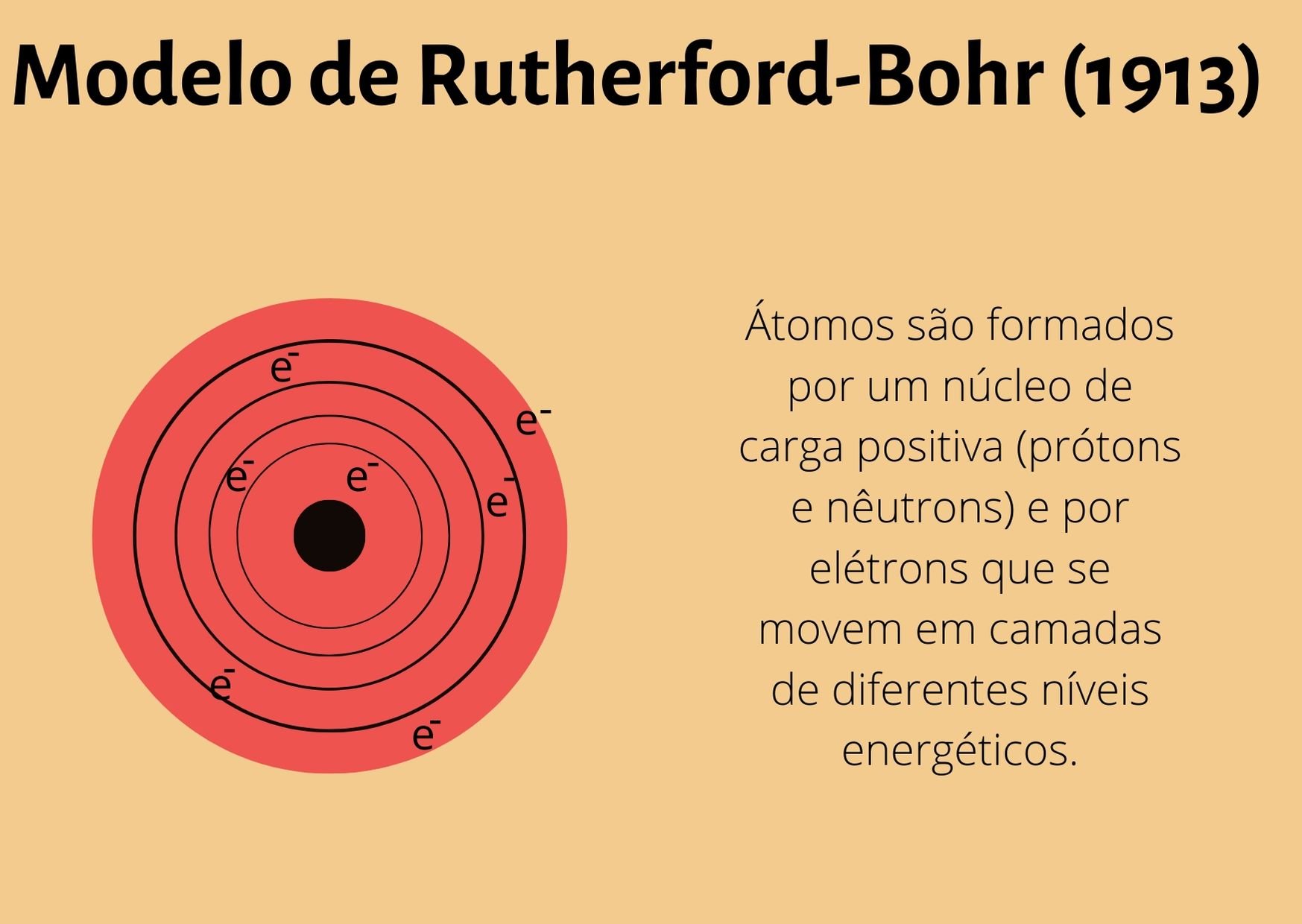
1913 - Modelo Rutherford-Bohr
O modelo de Rutherford foi complementado com descobertas realizadas pelo físico Niels Bohr em 1913. Bohr chegou à conclusão de que os elétrons orbitam a eletrosfera em camadas de diferentes níveis energéticos.
Os elétrons não absorvem nem liberam energia nesse movimento, por isso, se mantém em uma órbita com energia constante, o que impede que estes se choquem com o núcleo.
Características de um átomo
O que diferencia um átomo de outro é a quantidade de prótons, nêutrons e elétrons em sua composição. Os principais valores utilizados para identificar os átomos são a massa atômica e o número atômico.
Massa atômica
O valor da massa atômica é representado pela soma dos prótons e nêutrons presentes no núcleo do átomo.
A = z + n
Número atômico
O número atômico é o número de prótons no núcleo de um átomo, seu valor é representado pela letra z. Como em um átomo o número de prótons igual ao número de elétrons, temos:
z = p = e
O conjunto de vários átomos com mesmo número atômico forma um elemento químico. Todos os elementos químicos conhecidos estão representados na tabela periódica seguindo uma ordem crescente de número atômico.
Os elementos químicos são representados na tabela periódica por sua sigla e nome no centro, pela massa atômica na parte inferior e pelo número atômico na parte superior, conforme imagem:

- Massa atômica = 196,967
- Número atômico = 79
Átomos e moléculas
Um átomo é uma parcela muito pequena da matéria, ele é composto por um núcleo com prótons e nêutrons e por elétrons girando em torno do núcleo.
Uma molécula é um agrupamento de átomos do mesmo elemento ou de elementos diferentes, que juntos formam uma substância. Por exemplo:
- Dois átomos de oxigênio se unem e formam uma molécula de oxigênio (O2).
- Dois átomos de hidrogênio se unem com um átomo de oxigênio e formam uma molécula de água (H2O).
Veja também: Diagrama de Linus Pauling e Radioatividade.