O que são os Hidrocarbonetos (com exemplos)
Os hidrocarbonetos, também chamados de carbonetos de hidrogênio, são compostos orgânicos cuja composição tem apenas átomos de carbono (C) e de hidrogênio (H), tendo assim a fórmula geral CxHy.
Um hidrocarboneto consiste em uma estrutura de carbono à qual os átomos de hidrogênio se unem em ligação covalente.
Trata-se do composto mais importante no âmbito da química orgânica.
Todos os tipos de hidrocarboneto se oxidam facilmente, liberando assim, calor. Em sua maioria, eles não são dissolúveis em água.
Os hidrocarbonetos naturais são compostos químicos formados no interior da Terra (a mais de 150 km de profundidade) a uma grande pressão e chegam a zonas de menor pressão por meio de processos geológicos.
Onde são encontrados os hidrocarbonetos
A principal fonte de hidrocarboneto é o petróleo. Por conta disso, o hidrocarboneto está presente em vários derivados como querosene, parafina, gás natural, gasolina, vaselina, óleo diesel, GLP (Gás Liquefeito de Petróleo), polímeros (como, por exemplo o plástico e a borracha), dentre outros.
Esse composto orgânico constitui 48% da matriz de energia do Brasil.
A cadeia de carbono que constitui parte da composição de um hidrocarboneto é tetravalente, ou seja, pode realizar quatro ligações.
O carbono é capaz de estabelecer ligação com outros átomos de carbono e com hidrogênios através de ligações simples, duplas ou triplas.
Classificação dos hidrocarbonetos
A classificação dos hidrocarbonetos tem por base três especificidades: a forma da cadeia carbônica principal, as ligações das cadeias carbônicas, a presença de radicais alquila na cadeia carbônica e presença de heteroátomos dividindo a cadeia carbônica.
Forma da cadeia carbônica principal
No que diz respeito à forma da cadeia carbônica principal, a classificação dos hidrocarbonetos subdivide-se em alifáticos e cíclicos.
Confira no que consiste cada uma dessas formas de cadeia carbônica.
Hidrocarbonetos alifáticos
Os hidrocarbonetos alifáticos são formados por cadeias carbônicas abertas ou acíclicas. Nessas cadeias, os carbonos são terminais.
Exemplos:
Alcano
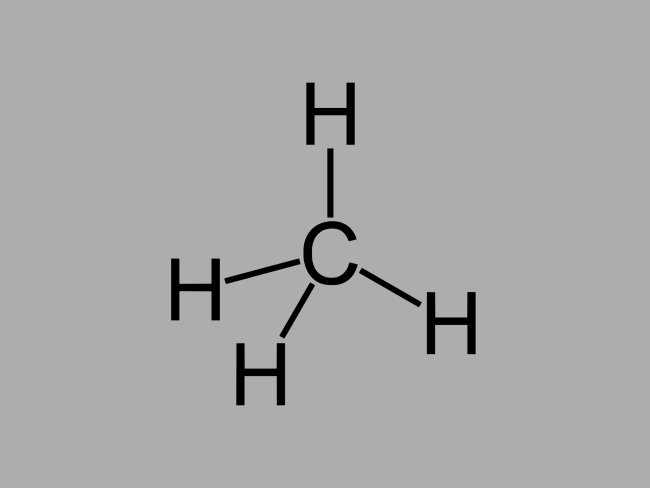
Os hidrocarbonetos alcanos, também chamados de parafinas ou parafínicos, são compostos oleosos onde só existem ligações simples entre os carbonos.
A fórmula geral de um alcano é CnH2n + 2 (n = qualquer número inteiro).
Alceno
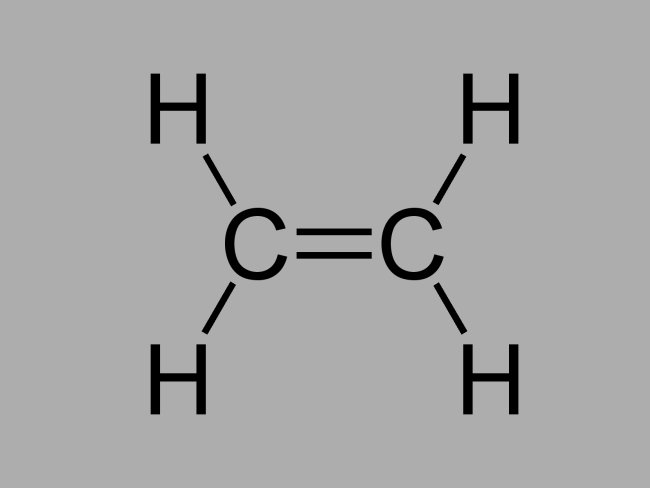
Também chamado de olefina, alqueno ou hidrocarboneto etilênico, o alceno é um composto pouco reativo onde existe ligação dupla entre os carbonos.
A fórmula geral de um alceno é CnH2n.
Alcino
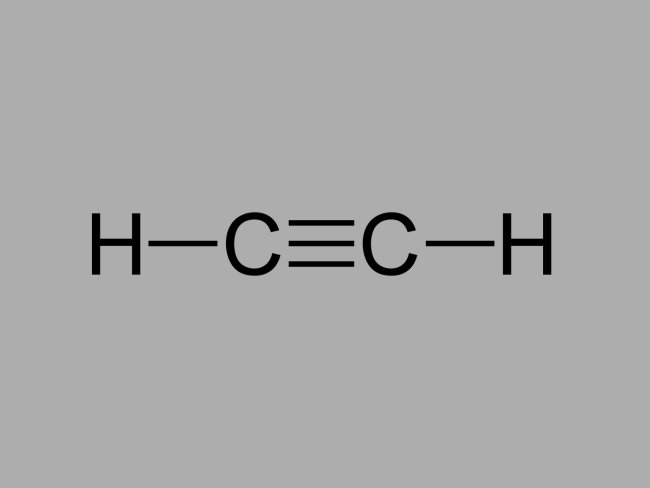
Também chamado de metilacetileno, o alcino é um hidrocarboneto onde as ligações existentes entre os carbonos são triplas.
A fórmula geral de um alcino é CnH2n-2.
Alcadieno
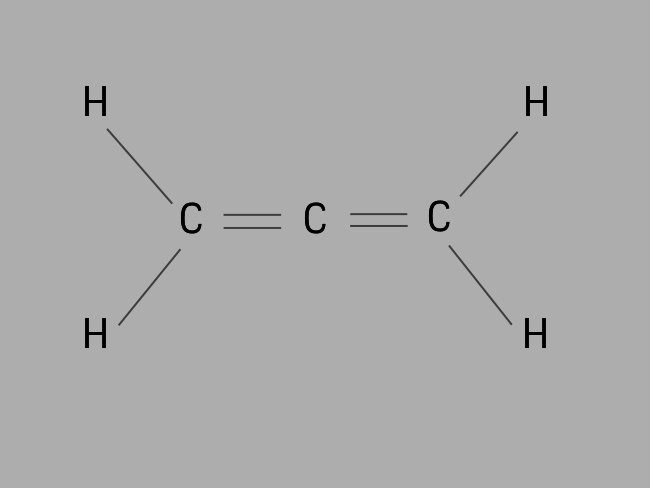
Também chamados de dienos ou diolefinas, os alcadienos são hidrocarbonetos onde as ligações existentes entre os carbonos são duplas.
A fórmula geral de um alcadieno é CnH2n-2.
Hidrocarbonetos cíclicos
Os hidrocarbonetos cíclicos são formados por cadeias carbônicas fechadas ou cíclicas. Essas cadeias não possuem carbonos terminais.
Exemplos:
Ciclano
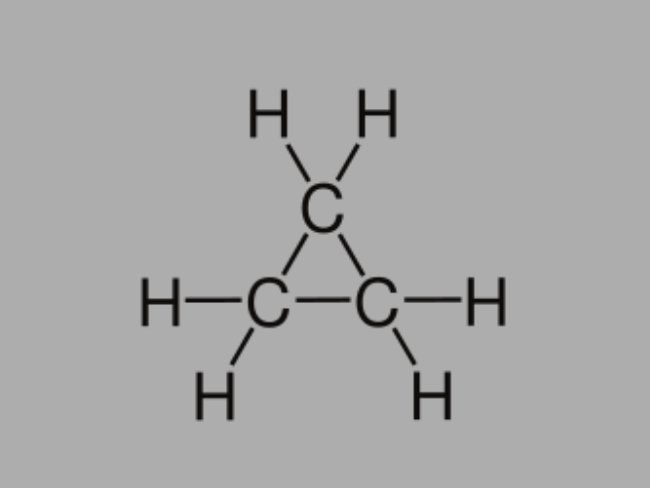
Também chamado de cicloalcano, cicloparafina ou hidrocarboneto naftênico, o ciclano é um hidrocarboneto saturado, composto por ligações simples.
Ele possui cadeia carbônica fechada e sua fórmula geral é CnH2n.
Cicleno
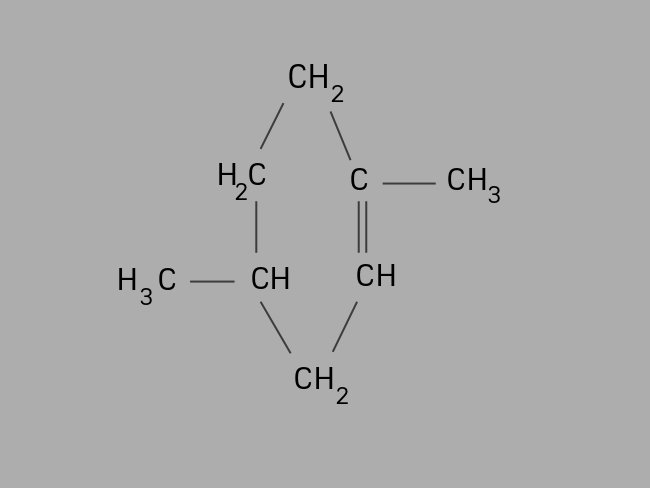
Também chamados de cicloalcenos, os ciclenos são hidrocarbonetos insaturados, compostos por ligações duplas.
Um cicleno possui cadeia carbônica fechada e sua fórmula geral é CnH2n−2.
Ciclino
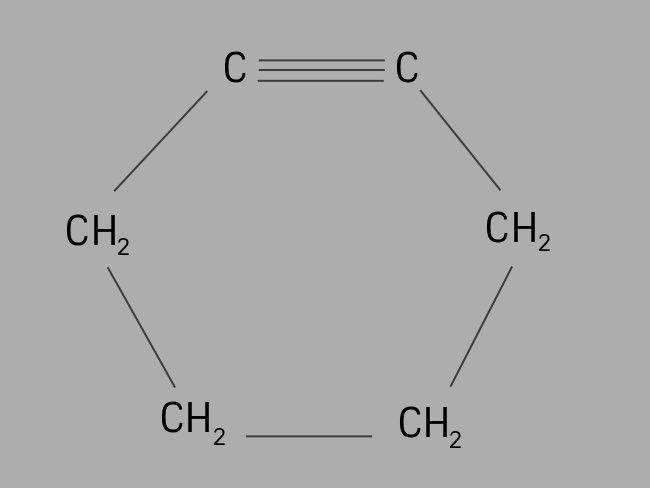
Também chamado de cicloalcino ou cicloalquino, o ciclino é um hidrocarboneto cíclico e insaturado.
Ele é formado por cadeia carbônica fechada, com ligações triplas e sua fórmula geral é CnH2n-4.
Aromático
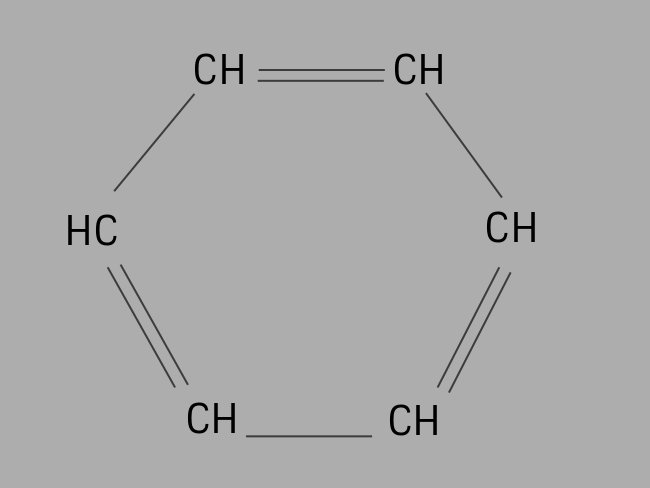
ou
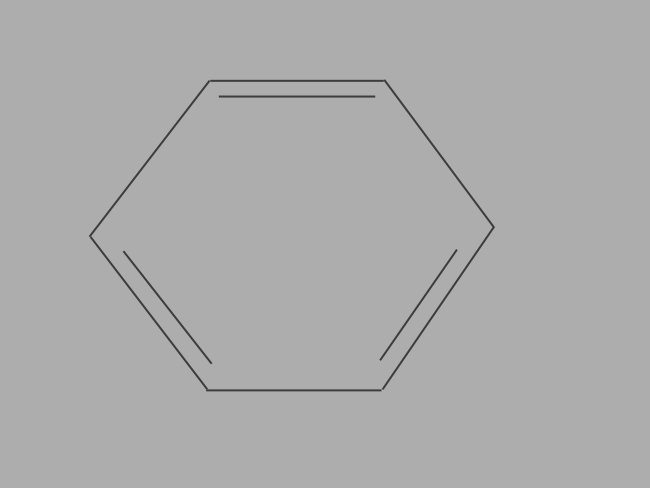
Também chamados de arenos, os hidrocarbonetos aromáticos são compostos insaturados formados por ligações duplas.
Um aromático possui cadeia carbônica fechada ou cíclica e sua fórmula geral é C6H6.
Tipo de ligação das cadeias carbônicas
Consoante o tipo de ligação das cadeias carbônicas, os hidrocarbonetos podem ser classificados em saturados ou insaturados.
Veja abaixo no que cada uma dessas classificações consiste.
Hidrocarbonetos saturados
Os hidrocarbonatos saturados são formados por ligações simples.
Exemplos: alcanos, ciclanos.
Hidrocarbonetos insaturados
Os hidrocarbonatos insaturados são formados por ligações duplas ou triplas.
Exemplos: alcenos, alcinos, alcadienos.
Presença de radicais alquila
Relativamente à presença de radicais alquila, os hidrocarbonetos podem ter cadeia carbônica normal ou ramificada.
Cadeia carbônica normal
Um hidrocarboneto de cadeia carbônica normal não possui radicias alquila.
Exemplo: pentano
Cadeia carbônica ramificada
Quando um hidrocarboneto tem uma cadeia carbônica ramificada, isso quer dizer que a cadeia carbônica principal dele possui radicais alquila.
Exemplo: metilpropano
Presença de heteroátomos dividindo a cadeia carbônica
A cadeia sequencial de carbono pode ou não ser dividida consoante a presença de heteroátomos.
Cadeia carbônica homogênea
Quando um hidrocarboneto tem cadeia carbônica principal homogênea, significa que essa cadeia não é dividida por heteroátomos.
Cadeia carbônica heterogênea
Se um hidrocarboneto possui uma cadeia carbônica principal heterogênea, essa cadeia teve a sua cadeia de carbonos dividida por um heteroátomo.
Nomenclatura de hidrocarbonetos
A nomenclatura dos hidrocarbonetos é definida através da combinação de três partes:

O prefixo identifica a quantidade de carbonos, o intermediário identifica o tipo de ligação e o sufixo indica a função à qual o composto pertence (nesse caso, à classe dos hidrocarbonetos).
Confira abaixo a lista de prefixos e intermediários que são combinados para designar os hidrocarbonetos.
Lista de prefixos
| Número de carbonos | Prefixo |
|---|---|
| 1 | Met- |
| 2 | Et- |
| 3 | Prop- |
| 4 | But- |
| 5 | Pent- |
| 6 | Hex- |
| 7 | Hept- |
| 8 | Oct- |
| 9 | Non- |
| 10 | Dec- |
Lista de intermediários
| Tipo de ligação | Intermediário |
|---|---|
| Só ligações simples | -an- |
| Dupla | -en- |
| Tripla | -in- |
| Duas duplas | -dien- |
Observe alguns exemplos de formação de nomes de hidrocarbonetos.
Exemplos:
CH3 – CH2 – CH2 – CH3
Na forma estrutural acima, podemos observar um composto de 4 carbonos que só tem ligações simples (indicadas através do símbolo “–”).
- Prefixo para 4 carbonos= but-
- Intermediário para ligações simples= -an-
- Sufixo de um hidrocarboneto= -o
Veja que a união do prefixo + intermediário + sufixo dá origem ao nome BUTANO.
CH2 = CH2
A forma estrutural acima possui 2 carbonos e 1 ligação dupla (indicada através do símbolo “=”).
- Prefixo para 2 carbonos= et-
- Intermediário para ligações duplas= -en-
- Sufixo de um hidrocarboneto= -o
Veja que a união do prefixo + intermediário + sufixo dá origem ao nome ETENO.
CH2 = CH – CH2 – CH3
CH3 – CH = CH2 – CH3
Observe que ambas as formas estruturais acima possuem 4 carbonos e 1 ligação dupla (indicada através do símbolo “=”).
Desta forma, temos:
- Prefixo para 4 carbonos= but-
- Intermediário para ligações duplas= -en-
- Sufixo de um hidrocarboneto= -o
Veja que a união do prefixo + intermediário + sufixo daria origem ao nome BUTENO para as duas formas estruturais.
No entanto, repare que as formas estruturais não são idênticas, logo as nomenclaturas também não podem ser.
A diferença entre as duas formas estruturais está na localização da dupla ligação.
Nesse caso, devemos numerar os carbonos da cadeia a partir da extremidade mais próxima da dupla. Sendo assim, nos casos em questão, devemos numerar da esquerda para direita.
Em CH2 = CH – CH2 – CH3:
- CH2 será o 1
- CH será o 2
- CH2 será o 3
- CH3 será o 4
Repare que a ligação dupla está entre o carbono 1 e o carbono 2.
Devemos utilizar o número menor (1) para localizar a ligação dupla: BUTENO -1
Em CH3 – CH = CH2 – CH3:
- CH3 será o 1
- CH será o 2
- CH2 será o 3
- CH3 será o 4
Repare que a ligação dupla está entre o carbono 2 e o carbono 3.
Devemos utilizar o número menor (2) para localizar a ligação dupla: BUTENO -2
Segundo a IUPAC (International Union of Pure and Applied Chemistry – União internacional de química pura e aplicada), a indicação da localização deve ser feita ligeiramente antes do que está sendo localizado (no caso das formais estruturais acima, a ligação dupla, representada pelo intermediário “-en-”).
Com isso, temos uma segunda forma, que por sinal é a mais correta, de escrever a nomenclatura das formas estruturais disponibilizadas.
CH2 = CH – CH2 – CH3: BUTENO -1 ou BUT-1-ENO (forma mais correta)
CH3 – CH = CH2 – CH3: BUTENO -2 ou BUT-2-ENO (forma mais correta)




